B7-H4 ADC波澜再起!辉瑞忍痛止损,翰森、百济等迎来机会?
在创新药的世界里,每一个靶点都承载着无数的期待与挑战,而B7-H4靶点掀起的波澜,无疑在近期最为引人瞩目。
日前,辉瑞在财报电话会上宣布计提29亿美元无形资产减值,其中10亿美元的“沉没成本”直指其B7-H4 ADC药物B7H4V(Felmetatug vedotin)的研发终止。这一消息快速引发医药圈关注,让这个曾被寄予厚望的新兴靶点再次成为焦点。

Felmetatug vedotin是辉瑞在2023年收购Seagen时获得的一款ADC。Seagen在2022年开始了该ADC针对晚期实体瘤患者的1期临床试验。2024年12月,Seagen停止了临床试验的招募。现在,辉瑞宣布最新的暂停将是永久性的。
“我们基于迄今为止生成的临床数据做出了商业决定,终止开发Felmetatug vedotin(FV),这些数据表明FV在晚期实体瘤患者(包括三阴性乳腺癌患者)中不太可能比标准化疗实现显著改善。”辉瑞的一位发言人对媒体表示。“在使用FV治疗的患者中,没有观察到新的安全性信号。”
据媒体披露,辉瑞的减值项目涉及多项管线资产,大部分是Seagen公司早前引进或者在研的项目,包括B7H4 ADC药物Felmetatug vedotin的10亿美元减值,口服酪氨酸激酶抑制剂图卡替尼的4亿美元减值,维迪西妥单抗的2亿美元减值等。辉瑞终止Felmetatug vedotin开发的决定,无疑为本就充满不确定性的B7-H4靶点又增添了一层阴霾。
明星靶点“熄火”辉瑞及时止损?
B7-H4是一种在肿瘤细胞中高表达但在正常组织中低表达的蛋白质,属于B7家族。B7家族是一类免疫调节蛋白,它们在免疫细胞的激活和调节中起着关键作用。研究发现,B7-H4在多种肿瘤中过表达,如三阴乳腺癌(TNBC,74%)、卵巢癌(OVC,77%)、子宫内膜癌(EC,94%)以及胆管上皮癌(CCA,89%),而在正常组织中表达有限,这使得它成为肿瘤治疗药物的理想靶点。
目前,针对B7-H4靶点的药物研发涵盖了单克隆抗体、双特异性抗体和抗体偶联药物(ADC)等多种新型药物。然而,至今尚未有针对B7-H4靶点的药物获批上市。
Felmetatug Vedotin是一款靶向B7-H4的ADC,最初由Seagen公司开发。2023年12月中旬,辉瑞以430亿美元的价格完成了对Seagen的收购。这笔交易不仅让辉瑞获得了Seagen的三款已上市ADC产品(Adcetris、Padcev、Tivdak),还带来了超过十款处于临床阶段的候选疗法,包括Felmetatug Vedotin。辉瑞对Seagen的ADC技术寄予厚望,期待通过这些药物进一步巩固其在肿瘤治疗领域的地位。
Felmetatug Vedotin在Seagen的开发阶段已经显示出一定的抗肿瘤活性。在2023年公布的Ⅰ期临床试验数据中,该药物在乳腺癌和其他实体瘤患者中表现出一定的客观缓解率(ORR),这些数据在当时被看作是积极的信号,也让辉瑞在2023年底收购Seagen时,对这款药物寄予厚望。
然而,随着时间推移,临床探索未知靶点的风险开始浮出水面。
2025年1月,同样布局B7-H4 ADC药物的Mersana Therapeutics公布,其B7-H4 ADC药物XMT-1660的1期临床数据,虽然在B7-H4高表达患者中取得了一定疗效,但在表达水平较低的患者中效果不佳。数据发布后,Mersana股价大跌45%。
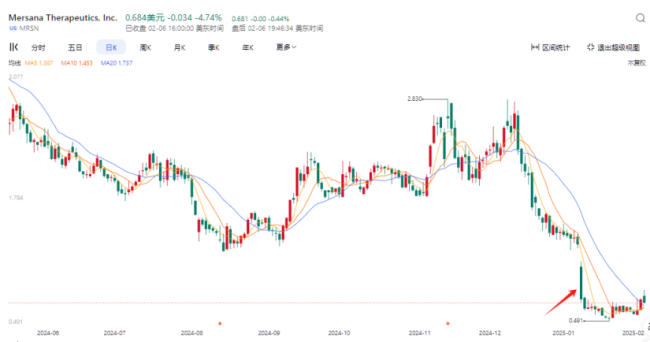
这一结果引发了市场对B7-H4 ADC药物疗效局限性的担忧,也为Felmetatug Vedotin的前景蒙上了阴影。
仅仅一个月后,2月4日,辉瑞在评估现有临床数据后认为,Felmetatug Vedotin不太可能在晚期实体瘤患者(包括三阴性乳腺癌)的标准化疗方案中取得有意义的改善。换句话说,尽管早期数据有一定的积极信号,但随着研究的深入,该药物在更广泛的患者群体中的疗效未能达到预期,特别是在B7-H4表达水平较低的患者中效果不佳。因此,辉瑞决定终止该药物的开发,并计提10亿美元的无形资产减值。
该消息一出,立即在行业内引起了广泛的讨论和关注,人们不禁开始重新审视B7-H4ADC的潜力,这个曾经被看好的靶点,是否真的还能在未来的药物研发中脱颖而出。
面对转折如何抉择?未知探索仍在持续
将时间拉回到两年前,B7-H4靶点在ADC领域崭露头角。也是在这一年,围绕B7-H4靶点的多款潜力在研药物迎来了多项重要的交易与合作。
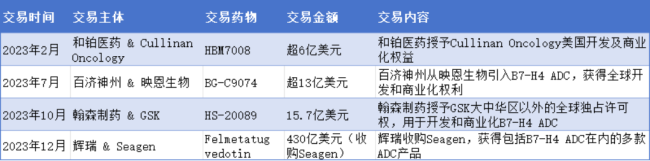
2023年2月,翰森制药与GSK达成合作,分别以15.7亿美元和17.1亿美元的交易金额将B7-H4 ADC药物HS-20089和B7-H3 ADC药物HS-20093的大中华区以外权益授予GSK。同年7月,百济神州以超13亿美元从映恩生物引入B7-H4 ADC药物BG-C9074。此外,和铂医药以超6亿美元将B7-H4靶点药物HBM7008的美国开发及商业化权益授予Cullinan Oncology,但该合作已于2024年8月终止。
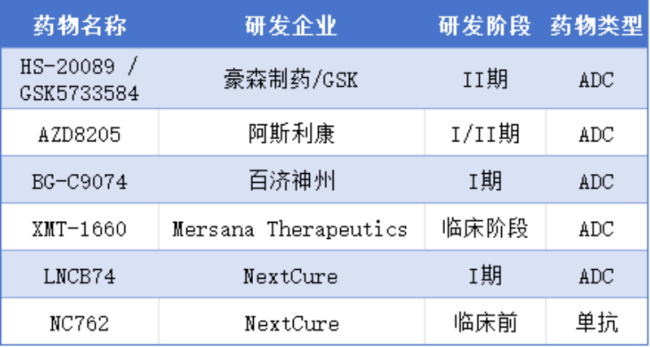
目前在研B7-H4靶点药物中,翰森与GSK合作开发的HS-20089/GSK5733584、阿斯利康的AZD8205、百济神州的BG-C9074、Mersana Therapeutics的XMT-1660以及NextCure的LNCB74,这些药物均处于临床阶段,适应症包括多种晚期实体瘤和妇科恶性肿瘤。此外,NextCure的单克隆抗体NC762也处于临床前阶段,适应症涵盖肺癌等实体瘤。
有业内人士指出,Mersana Therapeutics和辉瑞在B7-H4领域的失利并不一定意味着整个B7-H4靶点的前景黯淡,B7-H4仍是一个具有潜力的靶点。
在刚刚过去的JPM会议上,百济神州披露了B7-H4ADC产品BG-C9074的最新进展。目前,BG-C9074正在美国及澳大利亚开展1期临床研究,旨在评估该药物单药或联合替雷利珠单抗在晚期实体瘤患者中的疗效、安全性及药代动力学等指标。2024年4月12日,该研究已完成首例受试者的入组工作,计划共入组150名晚期实体瘤患者。初步结果显示,在一名51岁、已接受过四线治疗的卵巢癌患者中,24周时部分缓解(PR)率达到51%。这一积极信号表明,BG-C9074在特定患者群体中可能具有显著的治疗潜力。预计该实验的完整结果将在2025年公布。
此外,阿斯利康在2024年ESMO大会上公布了AZD8205的初步临床数据,研究显示该药物具有可控的安全性,并且有治疗晚期或转移性实体瘤患者的潜力。阿斯利康目前正在进行AZD8205单药治疗子宫内膜癌、卵巢癌、乳腺癌和胆道癌患者的2期剂量扩展队列研究,以及AZD8205联合PD-1xTIGIT双特异性药物rilvegostomig的剂量递增研究。
以及,翰森制药的HS-20089在临床试验中也取得了积极进展,根据2023年ESMO大会公布的数据,HS-20089在晚期实体瘤患者中显示出良好的耐受性和抗肿瘤活性,特别是在三阴性乳腺癌(TNBC)患者中,目标治疗剂量下的客观缓解率(ORR)达到41.7%。
这些积极的进展,无疑让人们看到了B7-H4靶点药物的潜力。
行业观点认为,辉瑞虽然被B7-H4 ADC上绊了一脚,终止Felmetatug Vedotin的开发,这可能与该药物的疗效、安全性或商业策略有关,并不意味着B7-H4靶点的开发前景黯淡,其他制药公司仍在荆棘中摸索前行,积极推进B7-H4靶点药物的临床研究,B7-H4靶点开发何去何从,《医药经济报》将持续保持关注。
相关推荐:
- 2025-02-11
- 2025-02-11
- 2025-02-11